
中国企业报集团主管主办
中国企业信息交流平台
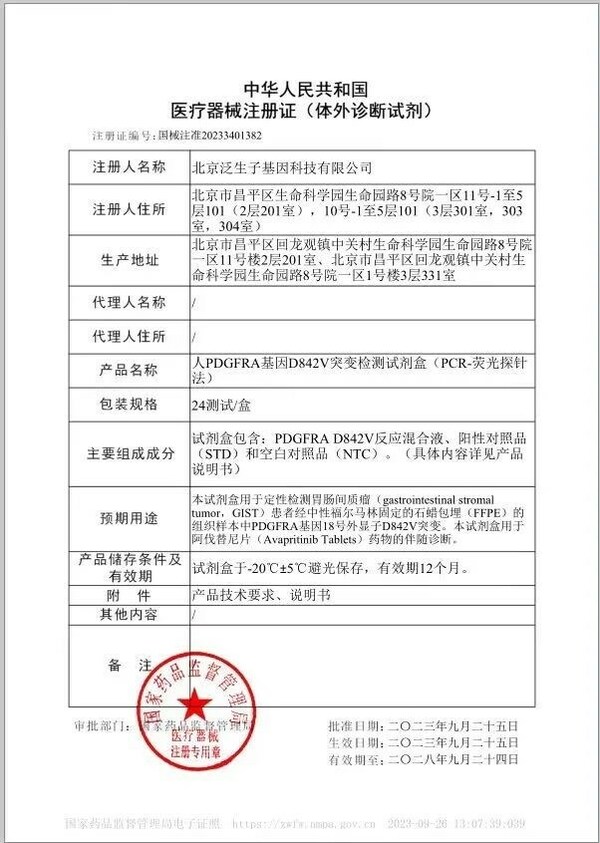
近日,泛生子注册的"人PDGFRA基因D842V突变检测试剂盒"(以下简称"试剂盒")获国家药品监督管理局(NMPA)批准,成为中国伴随诊断试剂指导原则出台后NMPA批准的首个以桥接路径开发的伴随诊断试剂盒。该试剂盒由泛生子与基石药业联合开发,可通过检测胃肠间质瘤(GIST)患者的PDGFRA基因突变,用于泰吉华®(通用名:阿伐替尼)药物的伴随诊断。
该试剂盒的上市,还实现了多项"首个":首个结合中国境内外药效数据批准上市的国产伴随诊断试剂盒;首个在《抗肿瘤药物的非原研伴随诊断试剂临床试验注册审查指导原则》和《与抗肿瘤药物同步研发的原研伴随诊断试剂临床试验注册审查指导原则》出台后以完整桥接路径上市的伴随试剂盒;首个药物和器械均获得NMPA优先审评的伴随试剂盒。
PDGFRA基因D842V突变的GIST患者一直缺乏有效治疗药物,而泰吉华®在PDGFRA基因外显子18突变(包括D842V突变)的不可切除性或转移性GIST中国患者中表现出优异的抗肿瘤活性,且安全性和耐受性良好,是中国首个获批用于治疗该疾病精准治疗的药物。该伴随诊断试剂盒是国内首个针对人PDGFRA基因D842V突变的试剂盒,以科学有效的临床数据作支撑,更精准的筛选出患者,匹配泰吉华®进行治疗,使患者得到更精准、更大的生存获益。
该试剂盒审批的整个流程数据充分、严谨,最终实现三年内审批落地。对此,泛生子联合创始人、董事长及CEO王思振表示:"本着为患者负责的态度,泛生子与基石药业秉持着同样严格的品质、效率标准。我们可为药企客户提供高效的伴随诊断服务,助力缩短药物研发周期,促进高效获批。在与合作伙伴联手推进创新产品的报证及应用过程中,我们更希望携手推动行业更规范,更标准,让合规的精准医疗惠及更多患者。"
基石药业首席科学官谢毅钊博士表示:"精准医疗是基石药业的核心策略之一。泰吉华®伴随诊断试剂盒的获批展示了我们在中国精准医疗伴随诊断开发方面的能力。此案例的成功归功于基石药业和我们经验丰富的诊断合作伙伴泛生子,以及Blueprint Medicines的共同努力。相信此伴随诊断试剂盒的获批和商业化,会使更多中国GIST患者从泰吉华®的治疗中获益。"
相关稿件