
中国企业报集团主管主办
中国企业信息交流平台
2023年世界卫生组织发布的最新统计数据显示,肺癌发病人数位居全球第二,为220万;死亡人数位居全球第一,为179万¹。肺癌主要分为两种类型:小细胞肺癌和非小细胞肺癌,其中小细胞肺癌约占肺癌的15%。吸烟是导致小细胞肺癌的主要原因之一,香烟烟雾中含有多种有机和无机致癌物质²。
小细胞肺癌的治疗现状和困境
化疗是小细胞肺癌的主要治疗方法。化疗之外具体的治疗方式,取决于是局限期小细胞肺癌还是广泛期小细胞肺癌。对于局限期小细胞肺癌,化疗通常与胸部放射治疗相结合。对于广泛期小细胞肺癌,化疗通常与免疫治疗相结合³。
小细胞肺癌一线标准治疗方案的地位在过去30年没有被撼动过,但是患者在接受标准治疗后的生存率,仍然有待提高。随着靶向治疗如火如荼的发展,许多学者为此探究了小细胞肺癌患者中能够指导治疗的标志物和靶向药物⁴。
安罗替尼四药联合方案,突破困境,迎来长生存期
自首次证实免疫治疗联合化疗可有效延长广泛期小细胞肺癌患者生存期以来,各项研究显示联合治疗中位总生存期(OS)一般在12-16个月之间,中位无进展生存期(PFS)在5-6个月之间,客观缓解率(ORR)在60%-70%之间。
2023年10月在新加坡举行的2023年世界肺癌大会(WCLC 2023)发布的一项研究数据显示⁵:安罗替尼+贝莫苏拜单抗+依托泊苷+卡铂的四药联合组治疗广泛期小细胞肺癌的中位总生存期达19.32个月!
该研究是一项III期临床研究,旨在探讨安罗替尼+贝莫苏拜单抗+依托泊苷+卡铂一线治疗广泛期小细胞肺癌的疗效和安全性,以1:1:1随机分为三组,分别接受贝莫苏拜单抗+安罗替尼+依托泊苷+卡铂后采用贝莫苏拜单抗+安罗替尼维持、安慰剂+安罗替尼+依托泊苷+卡铂后采用安慰剂+安罗替尼维持、安慰剂+依托泊苷+卡铂后采用安慰剂维持。
结果显示,四药方案组的中位OS显著长于对照组,分别为19.32个月 vs 11.89个月(HR=0.61.P=0.0002),远高于既往研究;独立评审委员会(IRC)评估的中位PFS分别为6.93个月vs 4.21个月(HR=0.32.p<0.0001)。此外,四药联合组三级及以上治疗相关性不良事件(TRAEs)发生率为93.1%(vs 87.0%),任意级别免疫治疗相关不良反应(irAEs)发生率为 42.7%(vs 19.1%),整体安全可耐受。
安罗替尼四药联合方案的研究数据远高于广泛期小细胞肺癌既往研究展示的生存数据,有望成为广泛期小细胞肺癌患者一线治疗新选择。那么,安罗替尼作为多靶点抗血管生成药物,在小细胞肺癌患者中是如何发挥作用的呢?
抑制肿瘤血管新生,促进血管正常化,增加抗肿瘤药物输送
肿瘤细胞在生长的过程中,会形成新生血管,来为接下来更疯狂的生长提供足够的营养和氧气。在此期间,肿瘤血管的结构是比较混乱的,化疗药物往往没有办法有效且持续的分布于肿瘤内部,对肿瘤细胞进行有效的杀伤。
安罗替尼具有“血管基质重编程“的作用,抑制肿瘤血管新生,同时促进血管正常化,增加其他抗肿瘤药物递送至肿瘤组织,是联合化疗、免疫检查点抑制剂协同增效的机制之一。
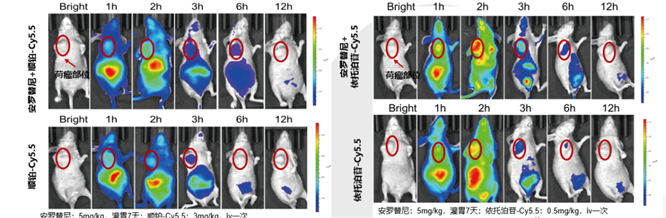
安罗替尼增加肿瘤组织中化疗药物分布(上图vs.下图)
抑制肿瘤细胞增殖和迁移,调节肿瘤代谢
肿瘤细胞具有过度增殖的特点,也具有异常的迁移能力,可以像蒲公英一样到处散播到身体其他地方,然后在散播到的地方开始恣意生长繁殖。肿瘤微环境中易出现缺氧,导致线粒体损伤,促进ROS生成、促进HIF-1α(转录因子)表达,并调控肿瘤发展和微环境。
安罗替尼可直接抑制肿瘤细胞增殖和迁移,也可间接地通过抑制肿瘤淋巴管生成进而抑制远处转移,同时改善肿瘤缺氧状态。
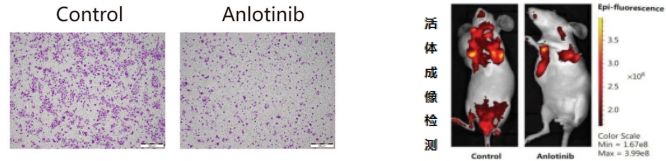
安罗替尼抑制肿瘤迁移⁶;安罗替尼抑制肿瘤远处转移⁷
调节免疫细胞构成和细胞因子水平,增强抗肿瘤免疫应答
肿瘤细胞开始在身体内恣意生长的时候,身体会发起抵抗,发动免疫细胞去杀伤肿瘤细胞。但是肿瘤细胞非常狡猾,它们会改造周边,为自己创造一个适合快速生长的免疫微环境,同时将可以杀伤他们的免疫细胞隔绝在外。这样一来自己便可以生长增殖的更加肆无忌惮。
安罗替尼可以打破肿瘤细胞为自己构建的生长乐园,增强免疫细胞浸润,调节肿瘤组织免疫细胞构成,调节细胞因子水平,进而增强抗肿瘤免疫应答。此外,联合免疫检查点抑制剂具有协同增效的作用。
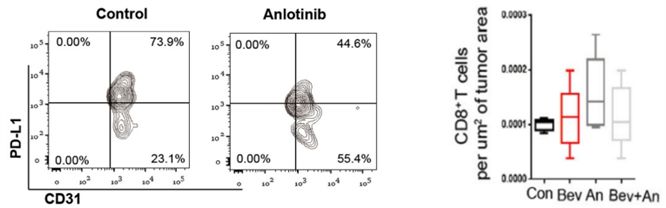
安罗替尼下调PD-L1表达,破坏肿瘤细胞乐园;安罗替尼增加CD8+免疫细胞数量⁸
总结
肺癌死亡人数位居全球第一,小细胞肺癌发病率约占肺癌的15%。随着靶向治疗如火如荼的发展,临床探索了这一疗法在小细胞肺癌患者中的应用。
安罗替尼作为抗血管生成靶向药物,可以抑制肿瘤血管生长,并促进血管正常化,增加抗肿瘤药物在肿瘤组织分布。同时,安罗替尼能够直接抑制肿瘤生长和转移;此外,安罗替尼还可以增强免疫细胞浸润,调节肿瘤微环境中免疫细胞构成和细胞因子水平,联合免疫治疗能够协同增效。相信在上述多种作用机制下,安罗替尼在未来能够为小细胞肺癌患者带来更多生存希望!
相关稿件